Określenia technologii stosowanych w nowoczesnej medycynie zarezerwowane dotychczas dla rozmów w gronie specjalistów, ze względu na coraz większa dostępność stają się używane w codziennym języku. W ten sposób słowo „chemioterapia” opisujące dotychczas ogół leczenia stosowanego w onkologii musi ustępować miejsca immunoterapii, czy jej poszczególnym rodzajom takim jak przeciwciała, inhibitory punktów kontrolnych, czy szczepionki przeciwnowotworowe. Do takich określeń należy również CAR-T, które kojarzy się z rewolucją w medycynie i nowoczesnością, choć jest tylko jednym z wielu sposobów użycia układu odporności w walce z dotychczas opornymi nowotworami.
Idea technologii CAR została stworzona pod koniec lat osiemdziesiątych, ale pierwsze badania kliniczne w przewlekłej białaczce limfocytowej i ostrej białaczce limfoblastycznej rozpoczęły się po 2010r. Określenie CAR opisuje to co decyduje o pomysłowości tej metody leczenia – skrót ten wziął się od angielskiego chimeric antigen receptors, czyli chimeryczne receptory antygenowe, które działając na powierzchni komórkach limfocytów T – dają nazwę technologii CAR - T.
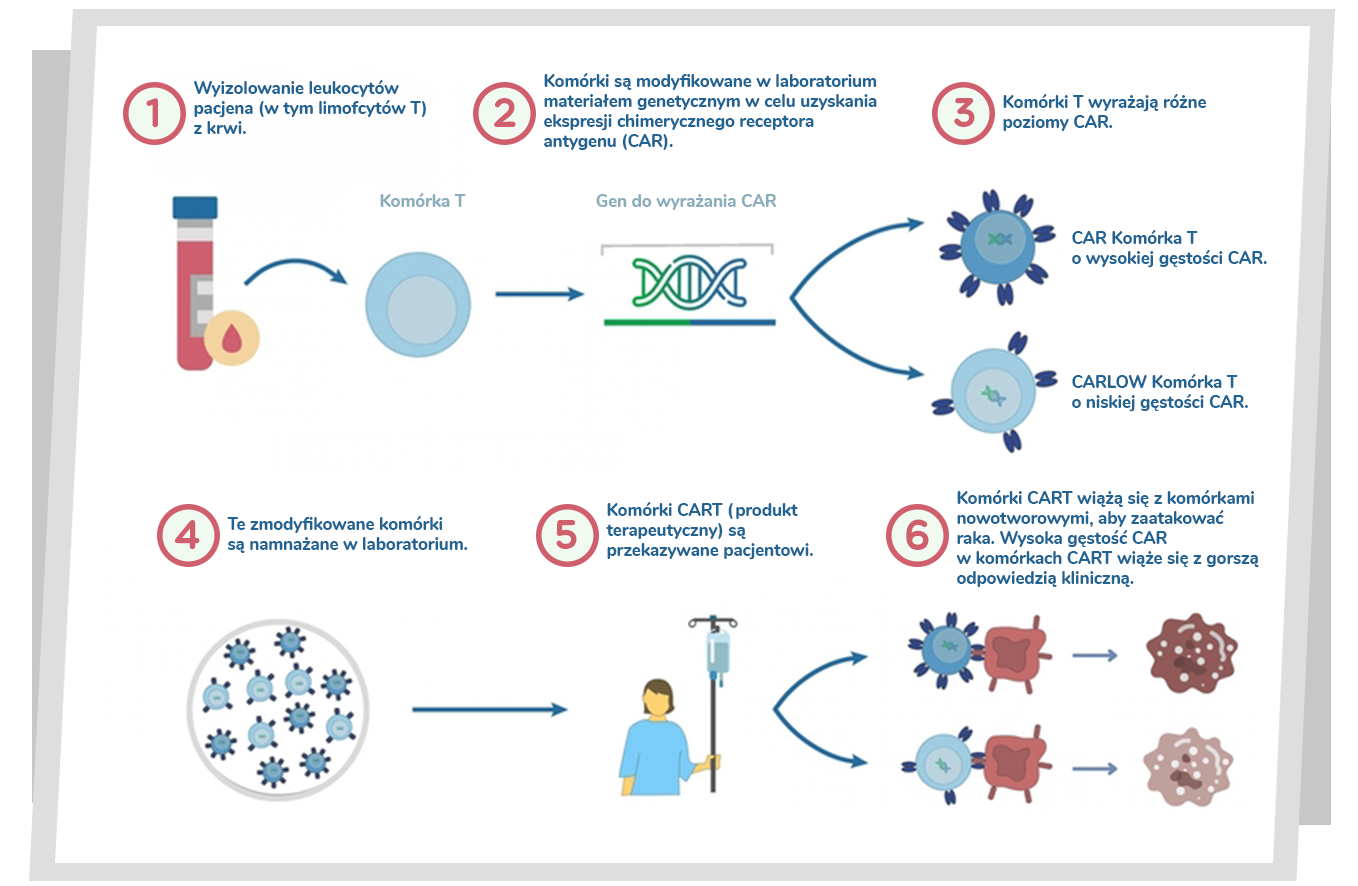
Jak działa CAR-T?
Wiemy o tym, że nasz układ odpornościowy walczy nie tylko z bakteriami i wirusami, ale broni nas przed nowotworami, a także pozwala rozróżniać własne tkanki i komórki od obcych. To dlatego ludzie z uszkodzonym układem odporności cierpią na częste infekcje, ale również częściej chorują na nowotwory i choroby autoimmunizacyjne. Wśród różnych komórek układu odporności to właśnie limfocyty T najczęściej odpowiadają za niszczenie komórek nowotworzenia, choć nie należy jednak zapominać tu o roli komórek NK, czy makrofagów. Wyobraźmy więc sobie chmurę komórek limfocytów T, którą jesteśmy w stanie nauczyć walki dokładnie z tym rodzajem nowotworu jaki rozwija się u danego pacjenta. Tworzymy grupę wyspecjalizowanych komórek, których jedynym celem jest niszczenie wroga. Do tego walka ta odbywa się tak długo, jak długo żyją te komórki , a nie tyle ile utrzymuje się stężenie leku we krwi.
W sposób bardziej szczegółowy technologia CAR-T polega na pobraniu od chorej osoby jego własnych limfocytów T, następnie w laboratorium przy pomocy wektora wirusowego (retro- lub lentiwirusa) wprowadzenie do ich środka genów pozwalających na zsyntetyzowanie na powierzchni komórki limfocytów receptorów , które będą rozpoznawać antygeny nowotworu. Tak przygotowane limfocyty namnaża się i następnie oddaje się z powrotem choremu, u którego wcześniej zastosowano terapię limfodeplecyjną mającą poprawić proliferacje i aktywację limfocytów chorego. Połączenie się receptorów limfocytów T z antygenem nowotworu wyzwala reakcję cytotoksyczną limfocytu, który zabije komórkę nowotworu, z którą się zetknie.
Te syntetyczne receptory które kierują limfocyty do rozpoznawania i eliminowania komórek nowotworowych to właśnie receptory CAR, a ich wytworzenie na powierzchni limfocytów T to technologia CAR-T. Komórki, które biorą udział w niszczeniu nowotworu są więc komórkami własnymi chorego – nie wyzwalają reakcji przeciwko obcym komórkom dawcy, co znamy z przeszczepień allogenicznych komórek szpiku. Ze względu na swoją budowę nie wymagają tzw. kostymulacji, czyli pomocy ze stronty innych komórek układu odpornościowego, co pozwala im być dużo skuteczniejszymi niż „zwykłe” komórki limfocytów. Receptory CAR możemy również stworzyć na powierzchni komórek NK albo makrofagów i mamy wtedy technologię CAR-NK lub CAR-M.
Jak jest zbudowany receptor CAR i czy to działa?
Każdy receptor CAR składa się z części pozakomórkowej, czyli domeny wiążącej antygen nowotworu, fragmentu przezbłonowego oraz domeny wewnątrzkomórkowej ze szlakiem sygnałowym wyzwalającym reakcję limfocytu. Receptor musi dysponować swoistością przeciwko antygenowi obecnemu na komórkach danego nowotworu. Komórki CAR-T skierowane przeciwko antygenowi CD19, który jest obecny na komórkach limfocytów B są najbardziej skuteczne w leceniu opornych i nawrotowych postaci chłoniaków z limfocytów B w tym rozlanego chłoniaka z dużych limfocytów B (DLBCL). W badaniach klinicznych tego leku uzyskiwano stopnie całkowitych odpowiedzi CR (complete response) na poziomie 40–54%, dla chłoniaka z komórek płaszcza MCL 67% a dla indolentnych chłoniaków w tym chłoniaka grudkowego FL, czy przewlekłej białaczce limfocytowej CLL 69–74% . Takie poziomy uzyskiwanych odpowiedzi są nieosiągalne dla klasycznych metod chemioterapii i spowodowały zmianę podejścia do terapii tych nowotworów. Nie wystarczy jednak uzyskać odpowiedź u opornego pacjenta, należy ją jeszcze jak najdłużej utrzymać, a najlepiej uzyskać całkowite wyleczenie. Najwięcej danych na temat odległych efektów terapii CAR-T mamy n a temat DLBCL i CLL i są to dane z okresu czasu w zakresie 24–123 miesięcy z medianą około 5 lat.
Wyniki te mogą sugerować, że część z chorych poddanych leczeniu w tych badaniach klinicznych można uznać za wyleczonych, a rezultaty są na pewno lepsze od uzyskiwanych przy pomocy klasycznych chemioimmunoterapii, które wymagały następnie konsolidacji procedurami transplantacyjnymi.
Taka skuteczność spowodowała zarejestrowanie terapii przez FDA w leczeniu chłoniaków, ale poza tym obserwuje się bardzo dobry efekt CAR-T antyCD19 w ostrej białaczce limfoblastycznej B-ALL na poziomie CR 71–81% choć ze zdecydowanie krótszym okresem trwania, co spowodowało rejestrację metody jako samodzielnej lub jako terapię pomostową przed allogenicznym przeszczepieniem szpiku. Dla B-ALL dysponujemy danymi z badań z medianą obserwacji jedynie około 1 roku (zakres 1–4.8 roku). Odsetek CR sięga 62% to 86%, z większością chorych MRD-negatywnych. Okres odpowiedzi jest trudny do określenia, bo w większości przypadków chorzy byli kwalifikowani do przeszczepień , a okresy obserwacji są za krótkie. Konieczność przeszczepień po CAR-T w B-ALL jest obecnie dyskusyjna jedynie dla populacji pediatrycznych, zaś u dorosłych fakt lepszych wyników po alloprzeszczepieniach wydaje się wskazywać na konieczność strategii pomostowej, bo pomimo świetnej skuteczności w przełamywania oporności choroby, to niestety tylko w mniej niż połowie przypadków obserwuje się dłuższe okresy bez progresji.
Innym antygenem przeciw któremu skierowane mogą być komórki CAR-T jest BCMA, czyli B cell maturation antygen, który to mechanizm jest stosowany w leczeniu opornego i nawrotowego szpiczaka plazmocytowego RRMM. W tym przypadku mamy jeszcze mniej danych z medianą obserwacji około 1 roku (zakres 13–48 miesięcy) Chorzy z RRMM osiągali stringent CR w 33% do 83% przypadków. Wielu chorych utrzymywało tą odpowiedź bez potrzeby dodatkowych konsolidacji przez lata z medianą okresu bez progresji od 5.2 do 27 miesięcy.
Zastosowanie metody CAR-T w innych nowotworach wymaga właściwego wyboru antygenu związanego z nowotworem stąd w trakcie badań klinicznych są technologie anty CD30 w chłoniaku Hodkina HL, Anty CD123 w ostrych białaczkach szpikowych AML, czy anty CD138 jako alternatywa dla BCMA w szpiczaku plazmocytowym.
Należy zwrócić uwagę, że trwają liczne badania na temat użycia technologii CAR-T w innych nowotworach niż nowotwory hematologiczne np.glioblastoma , neuroblastoma, potrójnie negatywny rak piersi, rak trzustki, rak jelita grubego.
Możliwości zastosowania
Aktualnie FDA zarejestrowała sześć technologii CAR-T. Cztery skierowane przeciw CD19 ( dwie stosowane w terapii chłoniaków i dwie w ostrej białaczce limfoblastycznej B-ALL) oraz dwie przeciw BCMA (stosowane w leczeniu szpiczaka plazmocytowego RRMM). Wszystkie zarejestrowane technologie to tzw. CAR-T drugiej generacji. Różnice w generacji polegają na dodawaniu dodatkowych elementów z reguły w domenie wewnątrzkomórkowej - I generacja receptorów CAR zawierała jedynie łańcuch CD3ζ W zaakceptowanych przez FDA technologiach domenami kostymulującymi są CD28 lub 4-1BB (CD137). Jeśli receptor zawiera oba mechanizmy to określamy go jako receptor III generacji. W badaniach klinicznych dysponujemy już czwartą generację CAR-T polegającą na dodaniu transgenów odpowiadających za produkcję cytokin np. IL12. (tzw. Komórki TRUCKs (T cell redirected for universal cytokine-mediated killing)), a nawet piątą generacją zawierającą dodatkowo do poprzednich rozwiązań wewnątrzkomórkowe domeny receptorów dla cytokin (IL-2R chain fragment) z fragmentami stymulującymi czynniki transkrypcyjne np. STAT-3/5.
Efekty uboczne
Stosowanie immunoterapii spowodowało, że profil efektów ubocznych leczenia onkologicznego gwałtownie się zmienił. Utrwalone skojarzenie związane z wymiotami, wypadaniem włosów i spadkiem masy ciała zmieniają się na rzecz zupełnie innego profilu powikłań, do którego nie są jeszcze przygotowani nie tylko pacjenci, ale i system opieki medycznej nie dostrzegający potrzeby edukacji pracowników medycznych oraz dostępności do diagnostyki w zakresie immunologii klinicznej. Wszystkie zarejestrowane CAR-T mają podobny zakres efektów ubocznych typowych dla tego mechanizmu działania. Najbardziej charakterystyczny jest zespół uwalniania cytokin cytokine-release syndrome (CRS) oswojony nieco przez podobieństwo do tzw. „burzy cytokinowej” występującej w infekcjach SARS CoV2 i wymagający specyficznej, nieraz intensywnej terapii medycznej. W trakcie CRS może wystąpić zespół hemafagocytowy lub bardziej kojarzący się reumatologią zespół aktywacji makrofagów (macrophage activation syndrome (MAS)), a także upośledzenie mechanizmów krzepnięcia krwi pod postacią koagulopatii związanej z zespołem CRS.
Drugim charakterystycznym powikłaniem są zespoły neurotoksyczności związanej z komórkami efektorowymi odporności (immune effector cell associated neurotoxicity syndrome), czyli zespół ICANS przebiegający z różnorodnymi, nieraz bardzo poważnymi objawami uszkodzenie centralnego układu nerwowego. Poza tymi objawami obserwuje się zespoły lizy guza spowodowane dużą skutecznością terapii, ale również aplazję limfocytów B z hipogammaglobulinemią oraz inne cytopenie mogące prowadzić do długotrwałego zespołu wtórnych niedoborów odporności.
Dzięki opracowaniu schematów działania większość z opisanych powyżej efektów ubocznych potrafimy leczyć i znacznie ograniczyć ich wpływ na skuteczność całego leczenia. Z pomocą przychodzą też biotechnolodzy projektujący kolejne modyfikacja receptorów w tym polegające na ograniczeniu toksyczności przez oddziaływanie na interleukiny stymulujące nadmierną odpowiedź zapalną, a także możliwość wyłączenia działania CAR (switches – przełączniki) przy zastosowaniu bezpiecznych substancji takich jak rituximab, czy dasatynib.
Oporność na CAR-T
Ograniczenia skuteczności tej formy leczenia są spowodowane przez zagrażające życiu powikłania, ale również przez mechanizmy oporności obserwowane w trakcie leczenia chorób nowotworowych. Ucieczka antygenowa, czyli Antygen escape polega na zmniejszonej dostępności do antygenów dla receptorów CAR, co może być spowodowane zarówno przez wcześniejsze intensywne leczenie, czy własne mechanizmy obronne nowotworu ograniczającego ekspresję np. CD19 czy BCMA na powierzchni swoich komórek. Rozwiązaniem tego problemu jest zwiększenie wachlarza rozpoznawanych antygenów , czyli tzw. Dual lub tandem CAR. W chwili obecnej eksplorowane połączenia to cd19/BCMA, CD19/CD22 lub w nowotworach piersi HER2/IL13Ra2.
Powtarzalne chemioterapie skutkują uszkodzeniem funkcjonalności własnych limfocytów T, co wpływa na skuteczność terapii przy ich zastosowaniu. Aktualnie stosujemy autologiczne limfocyty, czyli wymagane jest ich wcześniejsze pobranie od chorego. Trwają prace nad rozwiązaniem w postaci universal CAR-T (UCAR-T) otrzymywanych od zdrowych dawców co pozwalało by na korzystanie z tej technologii na zasadzie leku „off the shelf – z półki” , ale niestety ta forma niesie ze sobą ryzyko reakcji przeszczep przeciw gospodarzowi GVHD oraz reakcji odrzucania albo ograniczenia funkcjonalności limfocytów CAR.
Komórki NK ze względu na swoje działanie cytotoksyczne, a także łatwiejszą dostępność z linii komórkowych, krwi pępowinowej, krwi obwodowej lub komórek pluripotencjlanych – nie powodują reakcji GVHD, ale są jeszcze na etapie wczesnych badań.
Drugim mechanizmem oporności jest trudność z przenikaniem limfocytów w głąb tkanek nowotworowych, czyli ograniczenie infiltracji. Ten mechanizm odpowiada za trudności w zastosowaniu metody CAR-T w guzach litych. W trakcie badania są obecnie metody podawanie leku bezpośrednio do zmiany lub doopłucnowo w raku płuca, dokomorowo w guzach ośrodkowego układu nerwowego. Stosuje się również połączenia technologii CAR z modyfikacją chemokin, co pozwala na zwiększoną infiltrację limfocytów w obrębie chorych tkanek. Nie bez znaczenia pozostają mechanizmy wpływu mikrośrodowiska nowotworu , który działa wybitnie immunosupresyjnie blokując skuteczność limfocytów T, czy NK, skąd pomysł terapii łączonych z zastosowaniem leków - blokerów PD1 działających przeciwnowotworowo poprzez hamowanie tego mechanizmu.
Znaczącym ograniczeniem szerokiego stosowania technologii CART są wysokie koszty i długi cykl wytwarzania preparatu oraz ograniczenie funkcjonalności terapii wraz ze wzrostem ilości wcześniejszych linii leczenia. Koszty leczenia CAR-T w zależności od stosowanego preparatu wahają się w okolicy 1 mln USD. Do tego produkcja leku trwa kilka tygodni co powoduje, że w sytuacji szybkiej progresji ten czas może nie pozwalać na rozpoczęcie terapii u chorego. Obserwujemy specyficzny wyścig technologii immunoterapii – czy wygrają tańsze i szybciej dostępne wielospecyficzne przeciwciała lub koniugaty leków z przeciwciałem, czy terapie CAR, a może technologie szczepień przeciwnowotworowych pokaże czas, ale trudno wyobrazić sobie coś lepszego z perspektywy oczekującego na skuteczne leczenie chorego.
- Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021 Apr 6;11(4):69.
- Jogalekar MP, Rajendran RL, Khan F, Dmello C, Gangadaran P, Ahn BC. CAR T-Cell-Based gene therapy for cancers: new perspectives, challenges, and clinical developments. Front Immunol. 2022 Jul 22;13:925985
- Mehrabadi AZ, Ranjbar R. Therapeutic potential of CAR T cell in malignancies: A scoping review. Biomedicine & Pharmacotherapy. 2022 Volume 146,
- Lin H, Cheng J, Mu W, Zhou J, Zhu L. Advances in Universal CAR-T Cell Therapy. Front Immunol. 2021 Oct 6;12:744823
- Zhang X, Zhu L, Zhang H, Chen S, Xiao Y. CAR-T Cell Therapy in Hematological Malignancies: Current Opportunities and Challenges. Front Immunol. 2022 Jun 10;13:927153
- Saiz LC, Leache L, Gutiérrez-Valencia M, Erviti J, Rojas Reyes MX. Efficacy and safety of chimeric antigen receptor T-cell (CAR-T) therapy in hematologic malignancies: a living systematic review on comparative studies. Ther Adv Hematol. 2023 Apr 27;14:20406207231168211
- Qu C, Zhang H, Cao H, Tang L, Mo H, Liu F, Zhang L, Yi Z, Long L, Yan L, Wang Z, Zhang N, Luo P, Zhang J, Liu Z, Ye W, Liu Z, Cheng Q. Tumor buster - where will the CAR-T cell therapy 'missile' go? Mol Cancer. 2022 Oct 19;21(1):201.
- Cappell KM, Kochenderfer JN. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 2023 Jun;20(6):359-371.






